Medicatie bij MS
Per vorm van MS staat hieronder toelichting over de medicatie. Mocht u in meer achtergrondinformatie willen, klik dan op de uitklapbronnen. Uw neuroloog helpt u om samen de beste opties door te nemen voor behandeling.
MS is een auto-immuunziekte, daarom remt men de aanval door afweerremmende medicatie te geven (immers de eigen afweer veroorzaakt de klachten). Voor MS wordt hiervoor al jaren methylprednison gebruikt (of wel de MP-Kuur). Dit kan in een driedaagse kuur via het infuus worden toegediend. De eerste kuur wordt altijd in het ziekenhuis gegeven, maar bij vervolgkuren kan dit ook in de thuissituatie of via tabletten met (methyl)prednison.
Uit onderzoek is gebleken dat het uiteindelijke herstel na een schub MS-aanval niet beter is na een behandeling met methylprednison maar wel dat dit de snelheid van herstel en de duur van klachten sterk verbeterd. Bij beperkende MS-klachten worden kuren met prednison derhalve regelmatig toegediend, zeker gelet op bovengenoemde, in goed overleg met u als patiënt.
Het effect van de kuur is groter als de schub recenter is. Na 6-8 weken is er maar een zeer beperkt effect en is een MP-kuur gering bijdragend. Bij ernstige schubs kan er soms voor worden overwogen om de kuur te verlengen naar vijf dagen.
Belangrijke bijwerkingen zijn onder andere hoofdpijn, hoge bloeddruk, (tijdelijke) suikerziekte, kans op erger verlopende infecties, maagklachten, slapeloosheid en een psychische symptomen (zoals ontremming). Niet elke patiënt krijgt bijwerkingen in deze mate en in de regel worden de kuren goed verdragen maar er is dus een kleine kans op een ernstigere bijwerking.
Een minder gangbaar alternatief voor methylprednison is een driedaagse kuur via het infuus met gammaglobulines. Dit heeft een andere bijwerkingen profiel en kan ook veiliger in de zwangerschap gegeven worden.
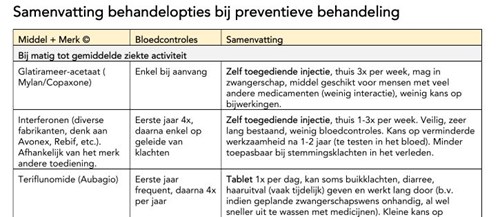
In onderstaand overzicht staan de behandelopties bij preventieve behandeling met medicatie van aanvalsgewijze MS (RRMS). De volgorde van de groepen middelen is willekeurig (klik op de link of de afbeelding).
Historie
Tussen de jaren 1990 en 2005 waren er weinig echt effectieve behandelopties voor MS. Middelen zoals interferonen, glatiramir-acetaat (eerder met de merknaam Copaxone, nu Mylan) bestaan het langste. Daarna zijn er verschillende pil-medicamenten en infuusbehandelingen bij gekomen. Momenteel komt er bijna elke jaar een nieuwe therapie uit, veelal dezelfde middelen met bijvoorbeeld een gunstiger bijwerkingen profiel.
Veel belovende therapieën zijn soms ook weer van de markt gehaald doordat ze toch ernstige en zeldzame bijwerkingen bleken te hebben. Een voorbeeld hiervan is daclizumab (2018) waarbij er in de praktijk toch een verhoogde kans bleek op herseninfecties, hetgeen pas opviel toen er grotere groepen patiënten aan het middel werden blootgesteld. Bij langer bestaande therapieën is het profiel van bijwerkingen vrijwel volledig bekend.
Eerste- en tweedelijns medicatie?
Historisch is er in Nederland voor MS-medicatie een systeem van eerste- en tweedelijns medicatie. MS-medicatie is duur (circa € 15.000 per jaar afhankelijk van het middel) en niet alle middelen worden vergoed als een eerste behandeling voor MS (bijvoorbeeld voor fingolimod en cladribine moet men al één ander middel hebben gehad wat niet genoeg hielp). Soms heeft dit ook met bijwerkingen te maken die gemiddeld heviger kunnen zijn bij de tweedelijns medicatie.
Tweedelijns medicamenten konden vroeger pas worden voorgeschreven als een eerstelijns medicament niet genoeg hielp. Deze regels maken dat u bij aanvang van de diagnose niet voor alle therapieën kan kiezen. Heden kunnen wij bij actieve MS direct kiezen voor een doortastende en effectieve behandeling, doordat deze in de tijd beschikbaar zijn geworden.
Wat doet een MS-therapie voor mij?
Kort door de bocht; het remt ziekteactiviteit; bijvoorbeeld het aanval schubs per jaar of mate waarin de ziekte toeneemt in de tijd. Zeker vroeg in de ziekte is het belangrijk om de ziekte zo goed mogelijk te onderdrukken. Als men hiernaar streeft, zal men dus geen nieuwe schubs en/of plekken accepteren onder de behandeling.
Dit betekent dus in de praktijk dat als u start met een middel dat gemiddeld 60% van de ziekte activiteit remt, u nog +/- 40% kans heeft dat het middel niet alle ziekte remt en dat u na 1 jaar moet kiezen voor een sterkere therapie. Dit kan onzekerheid geven, los van de gevolgen van onvoldoende behandelde ziekte.
Toch zegt een gemiddelde voor u als patiënt niet alles, het zegt wat over de sterkte van het middel in algemeenheid. Er zijn veel patiënten die geen ziekteactiviteit hebben op een middel wat op papier maar 40% remt maar in hun situatie (bijvoorbeeld bij laag actieve MS) hun ziekte afdoende behandeld. Vaak zijn dit ook nog middelen met minder bijwerkingen of een praktisch gemak dus dan toch de beste keuze die persoon betreft.
Andersom, als een MS patiënt zeer veel ziekte activiteit heeft is het beter om direct voor een sterke therapie te kiezen die b.v. 80-90% van de nieuwe MS aanvallen remt. Deze persoon heeft dan de beste kans om de komende jaren weinig tot minder last te hebben van zijn MS en is b.v. de keuze voor een bescheiden effect middel onverstandig waarbij deze persoon dan onnodig risico loopt op schubs en uiteindelijk toch over zal stappen op een sterker middel.
Wat bepaalt de keuze?
Geen enkele therapie is in staat om de ziekte te genezen. Het remt in een bepaalde mate de ziekteactiviteit (vooral nieuwe schubs en MS-plekken op de scans).
Behandelingen kunnen wel dusdanig effectief zijn dat patiënten vrijwel geen nieuwe klachten meer ervaren, geen schubs hebben en een relatief stabiel verlopende ziekte (vooral bij aanvalsgewijze MS).
Het lijkt er sterk op dat het beter is om de ziekte vroeg en krachtig te behandelen. Het effect van de behandeling (hoe krachtig de behandeling ook is) neemt af met de leeftijd en de duur van de ziekte. Dit heeft er onder andere mee te maken dat medicatie minder tot niet helpt in de secundair progressieve fase. De kracht van ons immuunsysteem neemt bij het ouder worden ook af en MS is dan vaak ook minder actief.
Als de ziekteactiviteit hoog is dan is een sterk afweerremmend middel geïndiceerd, waarbij de behandelzwaarte en risico’s in verhouding staan tot de ziekte.
Andersom, als er sprake is van een gunstig verlopende MS staan de risico’s van de sterkere therapieën niet altijd in verhouding tot de ernst van de MS en kan er in veel gevallen beter gekozen worden voor een mildere therapie (of met meer gebruiksgemak). Uw neuroloog kan u hierbij helpen.
Er zijn echter ook kuren die een patiënt 2-3x ontvangt met nadien een jarenlang ziekte remmend effect. Voorbeelden hiervan zijn onder andere cladribine (tabletkuur) en alemtuzumab (infuuskuur). Dit principe van een krachtige (tijdelijke) therapie vooraf met een langdurig behandeleffect wordt ook wel ‘inductietherapie’ genoemd.
Bijwerkingen
Zeker niet iedereen krijgt bijwerkingen, maar het is van belang om bijwerkingen te voorkomen. Bij alle middelen zijn er behandelprotocollen en wordt regelmatig bloedonderzoek gedaan om bijvoorbeeld stoornissen in de lever, nier en afweer functie vroegtijdig te signaleren. Hierin begeleidt de MS-verpleegkundige u.
Zwangerschap
Niet alle middelen zijn te combineren met een actieve zwangerschapswens. Bijvooreeld glatirameer-acetaat kan veilig gebruikt worden tijdens de zwangerschap en bijvoorbeeld tysabri kan tot het derder trimester gebruikt worden en is toch een zeer effectief MS-middel.
Effectieve anticonceptie is bij veel MS-middelen van belang gelet op de mogelijke nadelige effecten op de ongeboren vrucht mocht u toch zwanger worden.
Sommige middelen hebben kans op een gevaarlijke virusinfectie (PML)
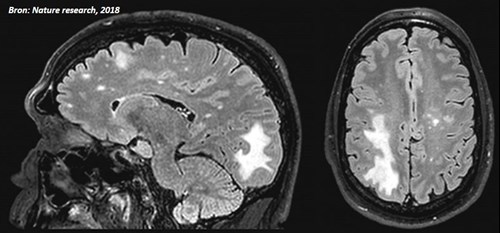
Dit betreft een gevaarlijke virusinfectie (of PML) van de hersenen veroorzaakt door het JC-virus. Het JC-virus is in opzet een onschuldig virus wat ook in de gezonde bevolking vaak voorkomt. Bij een ernstige stoornis in de afweer (of door bepaalde medicatie) kan het de hersenen infecteren. Het geeft neurologische symptomen die sterk kunnen lijken op MS en kan levensbedreigend zijn.
Tijdig herkennen is van belang. Hieronder ziet u een afbeelding van een scan met PML. De witte gebieden zijn aangedaan met de infectie. Bij middelen zoals tecfidera en fingolimod (waarschijnlijk ook bij ozanimod) is er een zeer kleine kans (circa 1:100000) dat hierbij een actieve PML-infectie ontstaan en vooral bij combinaties van afweerremmende medicamenten en een onderliggende aanleg, andere ziekten of lage afweercellen in het bloed.
Natalizumab geeft door zijn werking bij de bloed hersenbarrière een verhoogde kans op PML, maar enkel bij aantoonbare aanwezigheid bij het JC-virus. Bij chronisch gebruik van tysabri wordt hierom halfjaarlijks een JC test gedaan. PML ten gevolge van natalizumab treedt in de regel pas op na 2 jaar behandelen, zelfs indien JC positief getest. Mede hierom volstaat halfjaarlijks testen.
Als het virus niet aantoonbaar is dan kan de behandeling met tysabri veilig worden ingezet. Er is wel een kans dat men gedurende de behandeling toch het virus oploopt. Dit is praktisch niet te voorkomen.
Hoe hoger de mate van de aanwezigheid van het virus (titer), hoe hoger de kans op PML. Titers van 0.6 of lager worden gezien als minder risicovol, maar erboven, neemt het risico op de infectie PML snel toe in de tijd. Ooit is de kennis over PML verkregen toen tysabri nieuw op de markt kwam en er mensen ziek werden zonder dat men wist van het JC-virus in relatie tot de behandeling. Dit onderstreept dat er zeker bij een nieuwe therapie een hogere alertheid moet zijn voor zeldzame bijwerkingen.
Voor primair progressieve MS is met halfjaarlijkse infuusbehandelingen met ocrelizumab een effect op de snelheid van achteruitgang te zien (zie ook de Samenvatting behandelopties bij preventieve behandeling).
Met name PPMS patiënten - die relatief jong zijn en waar de ziekte nog niet zo lang bestaat, met veel ziekteactiviteit op de scans of vaak perioden van achteruitgang - hebben hier baat bij en staat de behandeling in verhouding tot de bijwerkingen en belasting.
Achtergrondinformatie PPMS
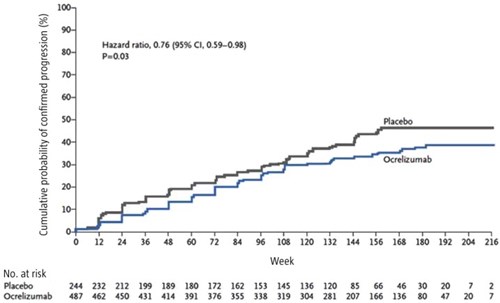
Hieronder nog een figuur uit de ORATORIO-studie (2017) met ocrelizumab bij patiënten met progressieve MS. +- in 2 jaar tijd gingen patiënten die werden behandeld met ocrelizumab 7-10% minder snel achteruit. Dit waren vooral de relatief jonge patiënten met ook nog wel ziekteactiviteit op de MRI-scan (mogelijk nog een iets groter effect in deze groep. Dit was nog niet eerder met andere middelen aangetoond vandaar dat ocrelizumab voor PPMS in Nederland voor de een vergoeding heeft verkregen voor vroege progressieve MS en/of actieve progressieve MS zich uitend in aanvallen en MRI-activiteit.
In de praktijk evalueren wij samen met u het behandeleffect van ocrelizumab na 2 jaar behandelen en wordt er besloten of continueren zinvol is.
Voor SPMS is er sinds begin 2021 de optie van siponimod. Deze tabletbehandeling helpt het beste bij SPMS patiënten die nog regelmatig schubs hebben of waarbij de MRI-scan nog veel tekenen van MS-activiteit toont. Qua bijwerkingen lijkt het op fingolimod en ozanimod (zie ook de Samenvatting behandelopties bij preventieve behandeling).
Er zijn veel studies die effectiviteit aantonen van autologe stamceltransplantatie bij MS. Het lijkt een sterke behandeling te zijn ter preventie van de schubs en ziekteactiviteit zoals meetbaar door de MRI.
Wij hebben ervaring met patiënten die elders zijn behandeld met autologe stamceltransplantatie en hebben hier begeleiding in geboden. De verwachting is dat op een zeker moment het een behandeling wordt in Nederland die kan worden aangeboden aan ernstige vormen van RRMS. Maar tot dan verwijzen wij u (net als alle andere neurologen in Nederland) naar het standpunt van de onze beroepsgroep. Lees hier ook meer over een studie naar de effectiviteit van AHSCT bij MS.